Criterios para gestionar la Integridad de Datos en la Validación de Sistemas Computarizados
QFB Jaime I. Castro Palma
20 de Agosto | 2017
Los sistemas computarizados, como parte del control, medición y gestión de los procesos farmacéuticos, son hoy en día una realidad que nos obliga a establecer nuevos paradigmas acerca de su evaluación y del manejo de la información, para garantizar la adecuabilidad al uso previsto.
Estos sistemas tienen dos funcionalidades principales en el entorno de las empresas:
- Automatizar actividades y procesos.
- Gestionar los datos de los procesos y sus actividades.
Pero hay de datos a datos. Por definición, según el Diccionario de la Real Academia Española, dato es:
1. m. Información sobre algo concreto que permite su conocimiento exacto o sirve para deducir las consecuencias derivadas de un hecho. A este problema le faltan datos numéricos.
2. m. Documento, testimonio, fundamento.
3. m. Inform. Información dispuesta de manera adecuada para su tratamiento por una computadora.
De esta manera, nos encontramos que los datos son la "información" que procesa un sistema computarizado para deducir o conocer algo y que, a su vez, pueden ser documentos o la información contenida en estos.
Si los sistemas computarizados no son capaces de mantener la integridad de los datos gestionados, existe el riesgo de que estos puedan ser falsificados, robados, alterados, eliminados o negados.
En este contexto, los datos de los cuales normalmente se desea mantener la integridad, son a su vez registros electrónicos, que suelen ser creados, modificados, archivados, recuperados y distribuidos mediante un sistema informático.
Al momento de iniciar las actividades de validación de los sistemas computarizados, es importante la identificación, caracterización y ponderación de los datos gestionados por el sistema, ya que su información contenida puede (o no) tener relevancia para demostrar el cumplimiento de las Buenas Prácticas de Fabricación.
La integridad de los datos de relevancia BPx (GxP) gestionados por los sistemas computarizados permite que estos permanezcan confiables a lo largo de su ciclo de vida y su periodo de uso.
¿Qué es y por qué es importante mantener la integridad de los datos?
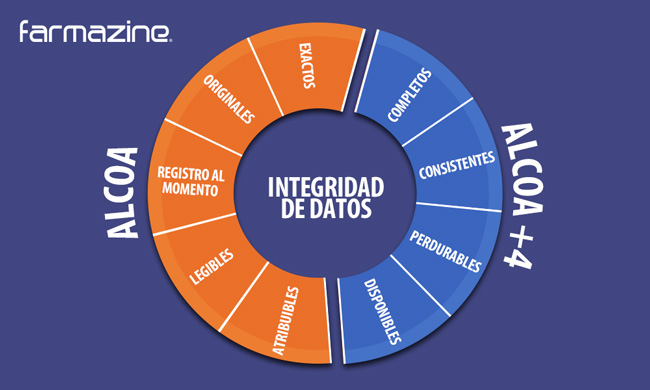
La FDA en su guía “Data Integrity and compliance with cGMP” establece que la integridad de datos es la capacidad de estos para ser:
- Atribuibles,
- Legibles,
- Registrados en el momento,
- Originales (o copias reales) y
- Exactos.
Estos atributos dan origen al acrónimo ALCOA (Attributable, Legible, Contemporaneously recorded, Original or a true copy, and Accurate). Posteriormente se añadieron otros, que robustecen su integridad (ALCOA+4):
- Completos,
- Consistentes,
- Perdurables y
- Disponibles.
De tal manera que la Integridad de Datos se logra a través del cumplimiento de los siguientes atributos para los datos gestionados por el sistema:
El ciclo de vida de la gestión de datos contempla las siguientes etapas:
- Generación de los datos.
- Procesamiento de la información.
- Reporte de los resultados del procesamiento.
- Verificación de los resultados.
- Uso de la información generada para toma de decisiones.
- Almacenamiento y resguardo de la información.
- Descartado y disposición al final del periodo de retención
La Integridad de Datos debe mantenerse en cualquiera de los siguientes casos:
- Cuando existe relevancia para el cumplimiento de las buenas prácticas.
- Cuando estos se convierten en evidencia de cumplimiento regulatorio.
- Cuando reflejan el cumplimiento de atributos de calidad del producto.
- Cuando contribuyen a la seguridad del paciente.
Si los sistemas computarizados no son capaces de mantener la integridad de los datos gestionados, existe el riesgo de que estos puedan ser falsificados, robados, alterados, eliminados o negados.
¿Cómo se mantiene la Integridad de Datos?
La Validación de los Sistemas Computarizados permite demostrar que estos son capaces de mantener la Integridad de Datos, entre otros atributos. Sin embargo, son los procesos de gobernanza los que permiten controlar y mantener dicha integridad.
La gobernanza de datos es el conjunto de acciones que proveen seguridad respecto a la Integridad de Datos y sus riesgos relacionados, independientemente del proceso, formato o tecnología con la cual fueron generados, registrados, procesados, retenidos, recuperados y usados.
Existen dos tipos de controles de gobernanza de datos para mantener la integridad:
- Organizacionales: Procedimientos, capacitación, verificación.
- Técnicos: Automatización, configuración, controles de proceso.
La constante innovación en las tecnologías de la información (TI) y los avances en la creación de sistemas que administran el Sistema de Gestión de Calidad, los inventarios y los sistemas para control de producción, suponen nuevos retos en materia de validación; particularmente en lo que respecta al mantenimiento de la Integridad de Datos.
Los procedimientos relacionados con los procesos de gobernanza de datos deben ser contemplados dentro de las verificaciones y pruebas de validación, tanto de los sistemas como de su infraestructura relacionada.
Entre los procesos y planes de soporte necesarios para disminuir el riesgo de pérdida de la Integridad de Datos se encuentran:
- Respaldo, archivo y restauración de la información.
- Gestión de usuarios y niveles de acceso.
- Gestión de seguridad física y lógica.
- Gestión de virus.
- Mantenimiento a sistemas.
- Acciones en caso de contingencias y desastres.
- Plan de continuidad de negocio.
- Plan de escalamiento de demanda.
Elementos del mismo sistema como el Audit Trail y el uso de firmas electrónicas, así como elementos de infraestructura como antivirus y firewall, contribuyen al mantenimiento y control de la Integridad de Datos
La integridad de los datos debe ser un proceso continuamente verificado, independientemente de las acciones de verificación relacionadas con la validación de los sistemas computarizados. Por lo tanto, deben realizarse revisiones rutinarias y documentadas a intervalos definidos para cada uno de los atributos de integridad, como parte del mantenimiento del estado validado.
Ya durante la validación, e incluso desde la concepción del sistema (independientemente de su categoría GAMP), deben establecerse requisitos de usuario para cada uno de los niveles de usuario, en donde se contemplen controles y elementos de proceso necesarios para el mantenimiento de la Integridad de Datos en todos los casos donde existan datos de relevancia BPx.
Así mismo y derivado de lo anterior, se deben analizar los riesgos relacionados y establecer controles físicos y lógicos que permitan minimizarlos o eliminarlos.
La constante innovación en las tecnologías de la información (TI) y los avances en la creación de sistemas que administran el Sistema de Gestión de Calidad, los inventarios y los sistemas para control de producción, suponen nuevos retos en materia de validación; particularmente en lo que respecta al mantenimiento de la integridad de datos. Las tecnologías asociadas a estos y su infraestructura, así como el cambio de paradigma computacional hacia sistemas basados en la nube, requieren el desarrollo de nuevos métodos de prueba específicos y la adquisición de competencias adicionales por parte del personal encargado de su validación.
Autor: QFB Jaime I. Castro Palma
Empresa: BPF part of QbD group SA de CV
Puesto: Director General
Más de 17 años de experiencia en cargos de jefatura, gerencial y directivo; gestionando proyectos y consultoría exitosos de largo alcance y duración para empresas farmacéuticas, farmoquímicas, biológicas, biotecnológicas, dispositivos médicos, centros de mezclas, almacenes de medicamentos, homeopáticos y naturistas tanto nacionales como multinacionales. Experto en Validación de Sistemas Computarizados, Calificación de equipos y Validación de procesos. Ponente en conferencias y más de 100 cursos impartidos en el Colegio Nacional de Químicos Farmacéucticos Biólogos México, Asociación Farmacéutica Mexicana, FarmaForum de Occidente, Simposio Nacional de Validación, Congreso Internacional Medico Farmacéutico Homeopático, Congreso Nacional de Ciencias Farmacéuticas. Colaborador en normas de Buenas Prácticas de Fabricación y en diversas revistas y plataformas digitales. Miembro de la ISPE. Revisor de las guías editadas por BPF part of QbD group.










