2 claves para aplicar Análisis de Riesgos en el Sistema de Control de Cambios
QFB Marisa Elena Ortiz Esparza
24 de Mayo | 2018
Para contar con un Sistema de Gestión de Calidad es mandatorio integrar la Gestión de Riesgos y aplicar el Análisis de Riesgos a las operaciones farmacéuticas, así como en los distintos elementos o subsistemas de dicho sistema.
Uno de estos subsistemas es el Sistema de Control de Cambios.
En esta ocasión comentaré 2 claves fundamentales para aplicar correctamente el Análisis de Riesgos en el Sistema de Control de Cambios y así robustecer el Sistema de Gestión de Calidad.
PRIMERA CLAVE: El Análisis de Riesgos no es para evadir cumplimiento regulatorio. Se aplica en aquello que no está regulado de manera específica en la ley, en las normas, farmacopeas, reglamentos o documentos oficiales; o en aquellos temas donde la normatividad nos indica realizar una justificación técnico-científica para definir algo en particular. Por ejemplo: parámetros de proceso, periodos y frecuencias de verificaciones, calificación, validación o auditorías, entre otros más.
Esto significa que todo lo que ya está definido en la regulación local e internacional no hay que justificarlo con Análisis de Riesgos, a menos que la misma ley lo permita.
Una práctica recomendable es incluir en la justificación técnica de diseño del sistema un Análisis de Riesgo
Un ejemplo de esto lo podemos encontrar en el Apéndice A contenido en la NOM-059-SSA1-2015 de Buenas Prácticas de Fabricación de medicamentos, publicada en el Diario Oficial de la Federación el 5 de febrero de 2016.
En dicho Apéndice, la columna de requerimientos de cambios de aire por hora muestra un subíndice “i”, el cual dice textualmente: “Este parámetro puede ser un indicador del adecuado diseño del sistema, por tanto si no existe cumplimiento al rango establecido en la tabla, debe investigarse y efectuarse la justificación técnica que evidencie que no existen fallas inherentes al diseño de las áreas”.
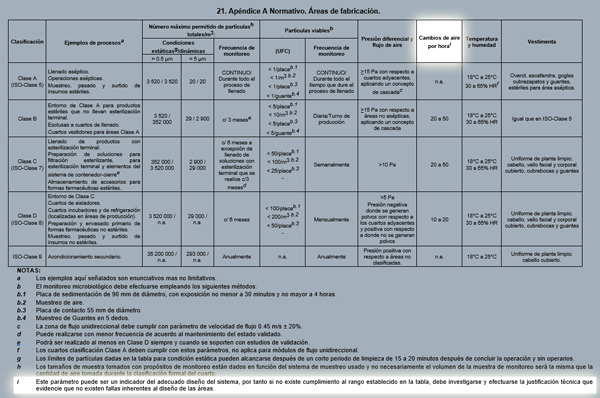
Para este caso, una práctica recomendable es incluir en la justificación técnica de diseño del sistema un Análisis de Riesgo, para atender cualquier preocupación sobre la calidad del producto(s) y/o seguridad del paciente al consumir el producto o productos fabricados en esas condiciones de diseño.
Todos los requisitos relacionados con el cambio se deben trabajar antes de que el cambio propuesto entre en aplicación
Al incluir dicho Análisis de Riesgo, seguramente se estará bajo cumplimiento regulatorio y a la vez se tendrá un documento técnico científico que respalde la decisión o la condición de diseño para los cambios de aire por hora por fuera de los límites marcados.
SEGUNDA CLAVE: La razón de ser del Sistema de Control de Cambios (SCC) es evaluar, entre otros puntos importantes, los riesgos asociados a la implementación del cambio, con un enfoque en el paciente, a través de las actividades involucradas en el ciclo de vida del producto y/o cadena de suministro.
Para ello se debe considerar que, si se cuenta con un SCC, entonces por default se aplicará el Sistema de Gestión de Calidad; es decir, todos los requisitos relacionados con el cambio se deben trabajar antes de que el cambio propuesto entre en aplicación.
Por lo tanto, el Análisis de Riesgo deberá estar enfocado en todo aquello que esté fuera de los requisitos ya establecidos y que podría afectar en alguna medida al paciente, al producto o ambos; esto bajo la premisa de que no todos los escenarios ni todas las situaciones pueden estar especificadas en la normatividad. La figura de abajo ilustra lo anterior:
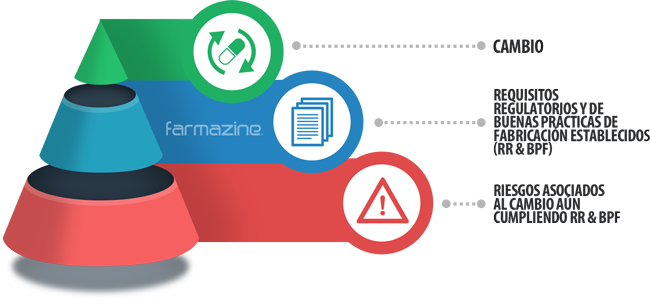
Utilizando los dos conceptos anteriores como principios para la aplicación de la Gestión de Riesgos, seguramente estará por buen camino el sistema de Control de Cambios; aunque en definitiva todos sabemos que la vivencia de los distintos casos que se presentan en el día con día puede tener muchas variantes.
Finalmente, en la medida que continuamente capacitemos a nuestro personal en el manejo de los sistemas de Calidad, Gestión de Riesgos, Herramientas de Análisis de Riesgo y en el Manejo del Sistema de Control de Cambios, se podrán implementar, robustecer y mejorar cada vez más los sistemas de Calidad, al contar con personal más calificado.
Autor: QFB Marisa Elena Ortiz Esparza
Empresa: Continuidad Profesional Humanista
Puesto: Dirección General
Autora del libro “Gestión y Análisis de Riesgo - Guía Práctica para su aplicación en la Industria Farmacéutica”. Master Trainer & Coach en Continuidad Profesional Humanista. Miembro activa de la Comisión de Calidad en la Asociación Mexicana de Profesionales en Regulación Sanitaria (AMEPRES). Conferencista sobre Sistemas de Gestión de Calidad, Gestión y Análisis de Riesgos, Auditorias Técnicas, Validación y Gestión de Riesgos para la Asociación Farmacéutica Mexicana, Aristos Pharma Forum, Colegio Nacional de Químicos Farmacéuticos Biólogos México A.C., Asociación Farmacéutica Mexicana de Occidente, Academia Nacional de Ciencias Farmacéuticas, entre otros. Con amplia experiencia en Recepción de Auditorías e Inspecciones de autoridades regulatorias como COFEPRIS, SAGARPA, FDA (EU), PMDA (Japón), ANMAT (Argentina), ANVISA (Brasil), INVIMA (Colombia).










